Cuando las células villanas se convierten en heroinas: aprovechar el canibalismo celular para tratar el cáncer
Publicado originalmente por la Universidad de California - Santa Bárbara, el 7 de enero de 2024
Una placa de Petri se transforma en un lienzo en la pintura de la estudiante de doctorado Hadley Hanson sobre macrófagos que engullen células cancerosas. Crédito: Hadley Hanson
Los científicos han resuelto el misterio de un asesinato celular casi 25 años después de que el caso se enfriara. Siguiendo un rastro de pruebas desde la mosca de la fruta hasta el ratón y el ser humano, se ha descubierto que las células caníbales son probablemente la causa de una rara inmunodeficiencia humana. Ahora, el descubrimiento podría mejorar un prometedor tratamiento contra el cáncer.
"Este trabajo nos lleva desde la biología celular fundamental de la mosca hasta la explicación de una enfermedad humana y el aprovechamiento de ese conocimiento para una terapia contra el cáncer", afirma Denise Montell, de la Universidad de Santa Bárbara. "Cada uno de esos pasos parece un descubrimiento importante, pero aquí están, todos en un solo artículo".
Los investigadores del laboratorio de Montell publicaron sus hallazgos en Proceedings of the National Academy of Sciences y ahora están investigando los mecanismos y las implicaciones.
Un gen antiguo
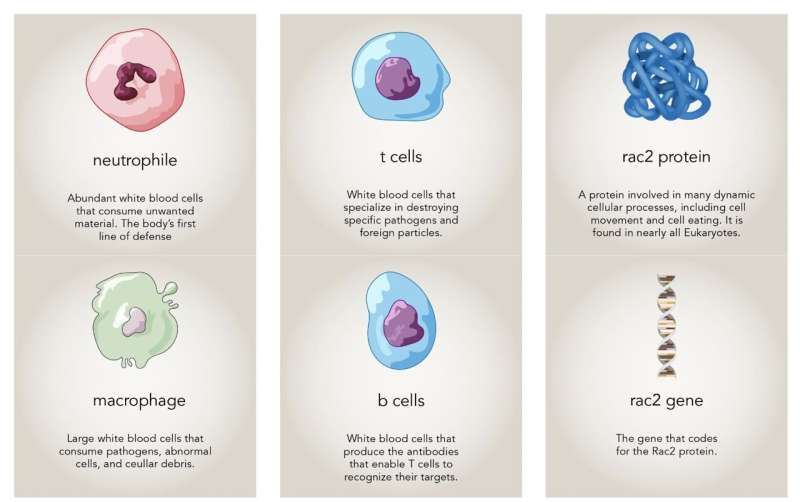
El personaje principal de esta historia es un gen, Rac2, y la proteína que codifica. Rac2 es uno de los tres genes Rac en humanos. "Rac es muy antiguo en la evolución, por lo que debe cumplir una función fundamental", afirma el autor principal Montell, Catedrático Duggan y Profesor Distinguido de Biología Molecular, Celular y del Desarrollo.
Las proteínas Rac ayudan a construir el andamiaje celular, denominado citoesqueleto. El citoesqueleto está formado por filamentos dinámicos que permiten a las células mantener su forma o deformarse, según sea necesario. En 1996, mientras estudiaba un pequeño grupo de células del ovario de la mosca de la fruta, Montell determinó que las proteínas Rac son fundamentales para el movimiento celular. Desde entonces, ha quedado claro que Rac es un regulador casi universal de la motilidad celular en las células animales.
Ya en los años 90, observó que una forma hiperactiva de la proteína Rac1, expresada sólo en unas pocas células de la cámara del huevo de una mosca, destruía todo el tejido. "Sólo con expresar esta Rac activa en seis u ocho células se destruye todo el tejido, que está compuesto por unas 900 células", explica el autor principal Abhinava Mishra, científico del proyecto en el laboratorio de Montell.
¿Por qué ocurre esto? ¿Cómo funciona? "Éste era nuestro caso pendiente desde hacía 25 años", explica Montell.
Hace unos años, empezaron a acumularse pruebas que implicaban canibalismo celular, en la destrucción de tejidos. Hay un paso en el desarrollo normal de los huevos de mosca en el que ciertas células similares a las del borde consumen a sus vecinas porque ya no son necesarias. De hecho, el canibalismo celular no es tan raro como cabría esperar: Cada segundo se eliminan del cuerpo humano millones de glóbulos rojos viejos.
Rac2 es uno de los componentes del complejo proceso de alimentación. Rac ayuda a la célula devoradora a envolver a su objetivo. El equipo tenía curiosidad por saber si una forma hiperactiva de la proteína provocaba que las células limítrofes devoraran prematuramente a sus vecinas.
Para que esto ocurra, las células limítrofes tienen que reconocer sus objetivos, lo que requiere un receptor particular. Efectivamente, cuando Mishra bloqueó este receptor, las células fronterizas que expresaban Rac activada no consumieron a sus vecinas, y la cámara del óvulo permaneció viva y sana.
"Se resolvió nuestro caso pendiente de hace 25 años, y eso fue muy satisfactorio para nosotros", exclamó Montell. "Pero se trata de un área bastante especializada del desarrollo de los huevos de Drosophila". Sin embargo, las implicaciones no tardarían en crecer.
Una misteriosa afección inmunitaria
En la misma época en que su laboratorio realizó el descubrimiento, Montell se enteró de un interesante estudio publicado en la revista Blood. En él se descubría que tres personas no emparentadas que sufrían infecciones recurrentes tenían exactamente la misma mutación, que hiperactivaba Rac2, una proteína Rac producida en las células sanguíneas. Sospechaba que la reciente revelación de su laboratorio en moscas de la fruta podría arrojar luz sobre este enigma.
La mutación de los pacientes sólo se activaba levemente, pero era suficiente para que todos sufrieran múltiples infecciones y acabaran necesitando trasplantes de médula ósea. Los análisis de sangre revelaron que estos pacientes casi no tenían células T, un tipo especializado de glóbulos blancos cruciales para el sistema inmunitario. El equipo de los Institutos Nacionales de la Salud insertó la mutación Rac2 en ratones y descubrió la misma misteriosa pérdida de células T. También descubrieron que las células T con Rac hiperactivo se desarrollaban con normalidad en la médula ósea de los animales y migraban al timo, donde seguían madurando sin incidentes. Pero luego parecían desaparecer. Así pues, el artículo terminaba con un misterio: ¿cuál era la causa de la desaparición de las células T?
Los autores de ese estudio habían observado que muchos de los neutrófilos de los pacientes -otro tipo de glóbulo blanco- estaban agrandados. Parecían estar consumiendo bastante material, un comportamiento inusual en una persona por lo demás sana.
Muchos aspectos del sistema inmunitario están implicados en estos hallazgos. Crédito: Matt Perko, UC Santa Barbara
Montell se preguntó si las células T de los pacientes estaban desapareciendo porque sus células inmunitarias innatas, como los neutrófilos con Rac2 activo, se las estaban comiendo, del mismo modo que las células del borde de la mosca de la fruta con Rac activo se comían la cámara del huevo. Su equipo se centró en los macrófagos -el homólogo más voraz de los neutrófilos- para investigar. Mishra cultivó macrófagos humanos con y sin Rac2 hiperactiva junto con células T. Observó que los macrófagos con Rac hiperactiva devoraban más células, lo que confirmaba la hipótesis del grupo a partir de su trabajo con moscas de la fruta.
Para comprobar si esto podría causar la inmunodeficiencia observada, la coautora Melanie Rodríguez (estudiante de posgrado en el laboratorio de Montell) tomó muestras de médula ósea de ratones con la misma mutación Rac2 hiperactiva encontrada en los pacientes. A continuación, transformó las células madre de la médula ósea en macrófagos y realizó un experimento similar al de Mishra, pero esta vez mezclando macrófagos y células T con y sin la mutación Rac2.
Descubrió que los macrófagos con Rac2 activo devoraban muchas más células T que sus homólogos normales. Sin embargo, las células T con Rac2 activo también eran más vulnerables al consumo por parte de cualquier tipo de macrófago. Así pues, la explicación más probable de la falta de células T en los pacientes era una combinación de un mayor consumo por parte de los macrófagos y una mayor vulnerabilidad de las propias células T. Un misterio médico humano resuelto a partir de observaciones fundamentales en moscas de la fruta.
Aprovechar el comportamiento de estas células enloquecidas
Las implicaciones de estos descubrimientos se ampliaron en enero de 2020, cuando Meghan Morrissey, coautora del estudio, se presentó a una entrevista para un puesto docente en la UCSB. En su charla describió la programación de macrófagos para que se coman las células cancerosas como un tratamiento novedoso para la enfermedad, un enfoque llamado CAR-M. Morrissey había descubierto que añadir un receptor CAR a los macrófagos fomentaba este comportamiento. Pero también estaba claro que, si se inducía a los macrófagos a comer más, el método sería más eficaz, sobre todo si consumían y mataban células cancerosas enteras.
Si algo habían aprendido Montell y su laboratorio era a hacer que los macrófagos comieran y mataran células vivas enteras. Así que colaboraron con Morrissey, ahora profesora adjunto de biología molecular, celular y del desarrollo, para determinar si la adición de Rac2 activado aumentaría la eficacia del enfoque CAR-M.
Rodríguez cultivó macrófagos de la médula ósea de ratones normales y mutantes con Rac2 activado. En cada uno de estos grupos, Morrissey expresó un receptor ficticio o el receptor CAR, que reconoce las células B (otro tipo de glóbulo blanco). Descubrieron que las células Rac normales e hiperactivas con los receptores ficticios no devoraba muchas células B objetivo. Los macrófagos normales con receptores CAR consumían muchas más células B, como Morrissey había demostrado anteriormente. Sin embargo, los macrófagos con Rac hiperactivo y receptores CAR consumieron el doble de células B que el grupo que sólo tenía CAR. La activación de Rac2 también pareció aumentar el número de los denominados "superdevoradores", macrófagos voraces que devoran y eliminan múltiples células cancerosas.
Los resultados dejaron claro que tanto el Rac activado como el receptor eran necesarios para el efecto potenciado. "Si se añade Rac activo sin el receptor adecuado, no se consigue nada", explicó Montell.
Este nivel de control es una buena noticia para cualquier tratamiento potencial, porque permitiría a los médicos centrar el ataque de los macrófagos modificados en las células cancerosas. También es de esperar que los médicos no tengan que preocuparse de que las células modificadas se coman las células T del paciente, ya que éstas no tendrían la mutación Rac2 activa que las hace más vulnerables, como Rodríguez había descubierto anteriormente.
Actualmente existe un tratamiento contra el cáncer denominado CAR-T, que utiliza el receptor CAR y las propias células T del paciente para atacar y destruir los cánceres. Es muy eficaz contra algunos tipos de cáncer, pero hay muchos que no responden. CAR-M, un primo más reciente de CAR-T, ha entrado recientemente en ensayos clínicos en humanos y hasta ahora parece seguro. Montell y su grupo están interesados en aprovechar los macrófagos CAR potenciados por Rac para aumentar la eficacia de los tratamientos CAR-M. Han solicitado una patente provisional para esta técnica, a la que denominan Race CAR-M, e invitan a empresas biotecnológicas a colaborar en el desarrollo del método.
Este nuevo trabajo multifacético plantea cuestiones tanto prácticas como de ciencia básica, que el laboratorio ha empezado a abordar. Están investigando si la técnica, tan eficaz en el laboratorio, funcionará también en células inmunitarias humanas recién extraídas y en modelos de cáncer en animales, en ratones y peces cebra. El equipo también está estudiando cómo Rac2 hace que todo esto ocurra a nivel molecular, en el interior de las células.
Más adelante, Montell quiere saber a cuántos tipos de cáncer podría dirigirse con éxito el tratamiento RaceCAR-M. A título comparativo, la CAR-T ha sido eficaz contra cánceres como la leucemia y el linfoma, pero no contra tumores sólidos como los de mama, pulmón o colon.
Los resultados han sorprendido a Montell, una prestigiosa bióloga celular con más de 100 trabajos a sus espaldas. "Este es mi trabajo favorito hasta ahora", afirma.
"Teníamos un caso pendiente desde hace 25 años en moscas de la fruta y lo hemos resuelto", añade Montell. "Y eso nos ayudó a resolver el misterio de una inmunodeficiencia humana inexplicable. Y luego aprovechamos ese conocimiento para mejorar una posible inmunoterapia contra el cáncer".
"Era un misterio tras otro, y Rac resultó ser la respuesta a cada uno de ellos".
Más información: Abhinava K. Mishra et al, Hyperactive Rac stimulates cannibalism of living target cells and enhances CAR-M-mediated cancer cell killing, Proceedings of the National Academy of Sciences (2023). DOI: 10.1073/pnas.2310221120
Publicado en: Proceedings of the Natural Academy of Sciences, Blood
Proporcionado por: University of Santa Barbara




Comentarios
Publicar un comentario