EarSkin con EarCartilage: combinación de piel humana modificada por bioingeniería y cartílago bioimpreso para reconstruir el oído externo
Publicado por Thamarasee Jeewandara, en Medical Xpress, el 16 de octubre de 2023
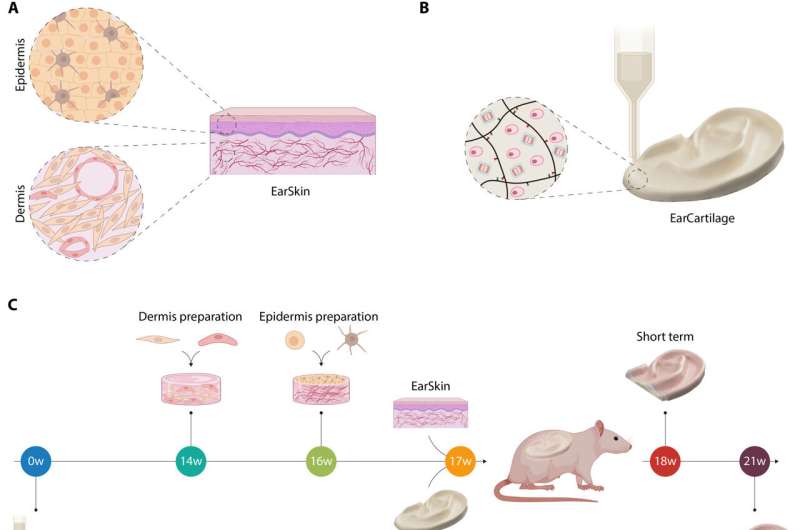
Esquema de la combinación de EarCartilage y EarSkin. (A) EarSkin se preparó mediante la creación de una capa dérmica fabricada a partir de fibroblastos humanos y células endoteliales microvasculares dérmicas humanas (HDMECs) en un hidrogel de colágeno I. Una vez madurada, se sembró una capa epidérmica de queratinocitos y melanocitos humanos sobre la parte dérmica. (B) EarCartilage se fabricó utilizando una biotinta basada en hialuronano transglutaminasa (HATG) junto con condrocitos auriculares humanos primarios. Los constructos postimpresos pueden reticularse enzimáticamente utilizando reticulación enzimática activada por calcio de factor XIII (30). (C) Cronología experimental de EarCartilage y EarSkin in vivo. EarCartilage se maduró durante 17 semanas antes de su implantación. EarSkin se creó combinando fibroblastos y HDMEC en un hidrogel de colágeno I y se maduró durante dos semanas antes de sembrar queratinocitos y melanocitos encima y cultivarlo durante una semana más. A continuación, los constructos se implantaron juntos in vivo y se analizaron al cabo de una semana (corto plazo) y cuatro semanas (largo plazo). (w, inicial de weeks, semanas en inglés). (D) EarSkin humano (A) y EarCartilage humano (B) se combinaron in vivo en un modelo de rata inmunodeprimida. Se creó una bolsa subcutánea por debajo del panículo carnoso a lo largo de la línea media dorsal en la que se transplantó EarCartilage. El panículo carnoso se utilizó para cubrir el armazón de EarCartilage y proporcionar una nutrición rápida a EarCartilage y EarSkin. A continuación, se transplantó EarSkin sobre el panículo carnoso. Crédito: Science Advances, DOI: 10.1126/sciadv.adh1890
La microtia es un trastorno congénito que puede presentarse como una malformación del oído externo en los niños. En un nuevo estudio publicado en Science Advances, Dominika Zielinska y un equipo de investigación en biología tisular, ingeniería de tejidos, tecnologías de polímeros y biofabricación de la Universidad del Hospital Infantil de Zúrich, la ETH de Zúrich (Suiza) y EE.UU., desarrollaron un tratamiento mediante ingeniería tisular utilizando un constructo de cartílago auricular autólogo bioimpreso como cartílago auricular, combinado con un sustrato de piel auricular humana pigmentada y prevascularizada mediante bioingeniería ya probado en ratas inmunodeprimidas.
El equipo confirmó la capacidad de los capilares sanguíneos humanos de EarSkin de conectarse a la vasculatura del receptor en una semana para una rápida perfusión sanguínea y maduración epidérmica. La EarSkin de bioingeniería mostró una epidermis estratificada con queratinocitos y melanocitos maduros, donde estos últimos residían dentro de la capa basal de la epidermis para restaurar eficazmente el color de la piel.
Otras pruebas in vivo mostraron una estabilidad mecánica favorable del cartílago de la oreja acompañada de una mejor deposición de matriz extracelular. Las marcas comerciales combinadas de Earskin y EarCartilage representaron un nuevo enfoque para el tratamiento de la microtia, para superar los límites y mejorar los resultados estéticos de la reconstrucción de microtia.
Caracterización de la microtia para los injertos de ingeniería tisular EarSkin y EarCartilage
En las afecciones congénitas, la microtia se puede caracterizar por el desarrollo anormal del oído externo en la etapa fetal, abarcando desde deformidades menores hasta la ausencia total del pabellón auricular. La microtia afecta a una amplia población infantil en todo el mundo, influyendo en su bienestar psicosocial, y las estrategias de tratamiento actuales sólo pueden aplicarse a partir de los 10 años. El método de referencia para tratar la microtia es la reconstrucción autóloga del cartílago costal, que puede extraerse de la caja torácica para crear una estructura de injerto auricular.
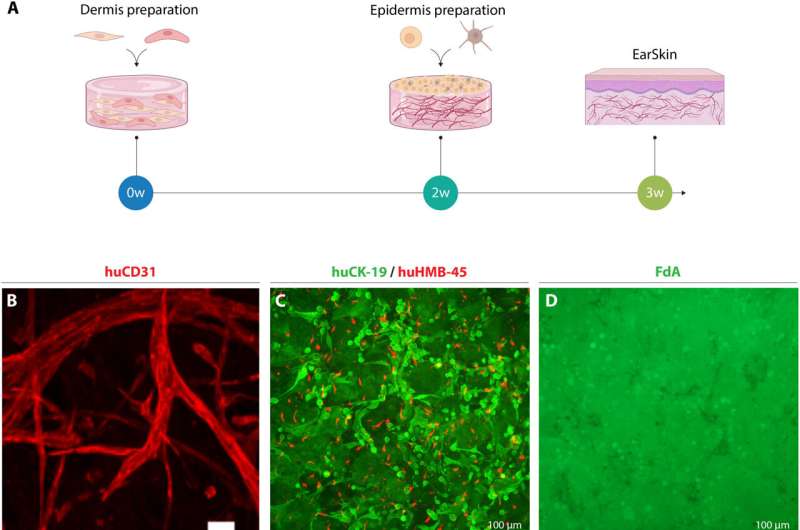
Desarrollo de EarSkin in vitro. (A) Ilustración de la preparación de sustitutos humanos-EarSkin dermoepidérmicos y prevascularizados. Los fibroblastos y las HDMEC se combinaron con un hidrogel de colágeno I para crear una capa dérmica prevascularizada y se cultivaron durante dos semanas in vitro. A las dos semanas, se sembraron queratinocitos y melanocitos encima de la capa dérmica para crear la capa epidérmica. (B) Imagen confocal representativa de la tinción de inmunofluorescencia de montaje completo para CD31 específica humana (rojo) que muestra la formación de capilares ramificados por HDMECs. Barra de escala, 100 μm. n = 6. (C) Imagen de superposición inmunofluorescente de tinción de montaje completo para citoqueratina 19 humana (CK19) (verde) y HMB-45 humano (rojo) que demuestra la distribución uniforme de melanocitos (rojo) dentro de los queratinocitos (verde) una semana después de la siembra. Barras de escala, 100 μm. n = 6. (D) Tinción con diacetato de fluoresceína (FdA) (verde) para evaluar la viabilidad celular, la presencia de una formación de capa epidérmica continua y la cobertura de queratinocitos sobre EarSkin una semana después de la siembra. Barras de escala, 100 μm. n = 6. Crédito: Science Advances, DOI: 10.1126/sciadv.adh1890
A continuación, este constructo se implanta bajo la piel del cráneo para elevar el pabellón auricular en una segunda fase de un procedimiento de cirugía plástica muy complejo. La intervención requiere cosechar una cantidad suficiente de cartílago costal, por lo que suele retrasarse hasta que los niños tienen 10 años.
Aunque la implantación de estructuras con polietileno poroso de alta densidad puede evitar la extracción de cartílago costal, los implantes sufrían mayores tasas de complicaciones. En este trabajo, el equipo combinó el sustituto de piel humana pigmentada y prevascularizada (Earskin) con cartílago bioimpreso (EarCartilage) como primer intento de utilizar dos injertos de ingeniería tisular para tratar a pacientes con microtia sin complicaciones.
Evaluación de EarSkin en el laboratorio y desarrollo de cartílago humano bioimpreso
in vitro
Para desarrollar la EarSkin por bioingeniería, el equipo incorporó un injerto de piel dermoepidérmica de origen humano basado en un hidrogel de colágeno tipo I con una capa dérmica prevascularizada y una dermis pigmentada encima. El equipo co-cultivó células endoteliales microvasculares dérmicas humanas con fibroblastos humanos en la dermis, formando capilares ramificados dispuestos en un plexo vascular en dos semanas de cultivo in vitro. El número de capilares y su longitud aumentaron significativamente con el tiempo.
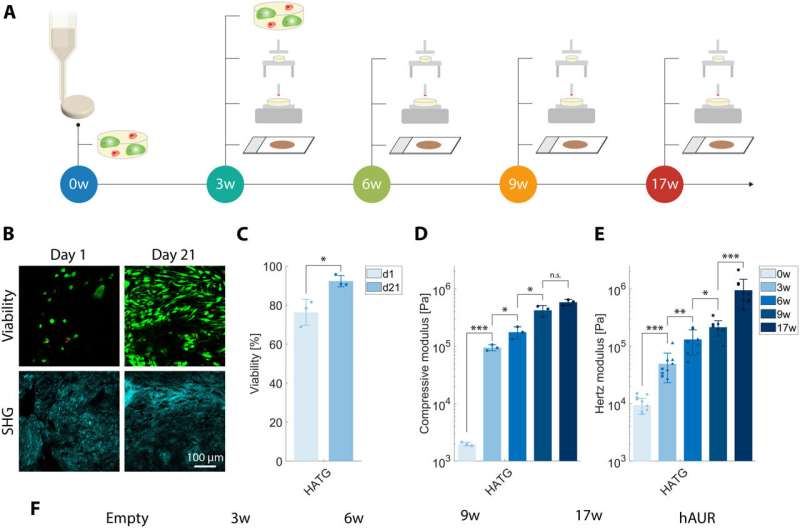
El tejido mantuvo una compleja composición de matriz extracelular en la que el cartílago resistió cargas significativas. El equipo comprobó la maduración de los constructos de cartílago tras bioimprimir los discos celulares y estudiar sus propiedades mecánicas para demostrar que la matriz extracelular de los constructos de ingeniería tisular, se debían a la red elástica madura del cartílago auricular humano.
IMAGEN
Desarrollo de cartílago in vitro. (A) Ilustración de la evaluación del desarrollo de discos de cartílago bioimpresos. Los discos se imprimieron utilizando una biotinta basada en HATG junto con condrocitos auriculares humanos primarios (hAUR). Los días 1 y 21 del proceso, se analizó la viabilidad celular. Después de 0 (muestras reticuladas que contenían 15 millones de hAUR ml-1, un día después de la bioimpresión), tres, seis, nueve y 17 semanas, se evaluaron las propiedades biomecánicas e histológicas. (B) Viabilidad celular (verde: vivo, rojo: muerto) y segunda generación armónica (SHG) después de uno y 21 días. Barra de escala, 100 μm. n = 3. (C) Viabilidad celular calculada a partir de imágenes de viabilidad celular. Se contaron las células viables (verdes) y muertas (rojas), y la viabilidad celular se calculó como el número total de células viables dividido por el número total de células (viables + muertas). n = 3. (D) Desarrollo del módulo de compresión y (E) módulo de Hertz de los discos a lo largo del tiempo. n = 3. (F) Histología de la deposición de glicosaminoglicano (Safranina O), colágeno I, colágeno II y elastina a lo largo del tiempo. Barras de escala, 200 μm (primer plano) y 2 mm (vista completa). n = 3. *P < 0,05, P < 0,01, P < 0,001, prueba t no apareada. Crédito: Science Advances, DOI: 10.1126/sciadv.adh189
Combinación de EarSkin con discos de cartílago in vivo
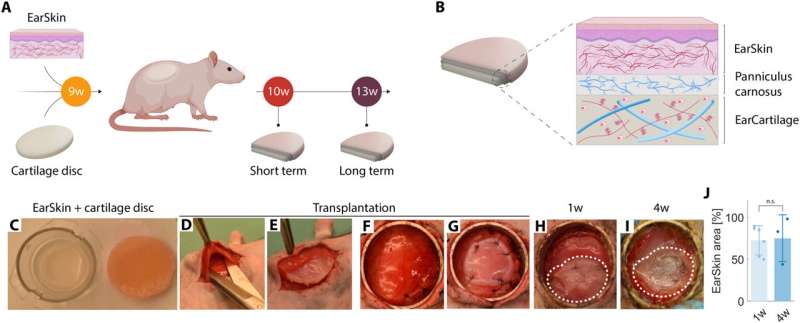
Los científicos desarrollaron un modelo de rata in vivo para imitar la combinación de piel y cartílago para tratar la microtia. Establecieron el modelo realizando un primer experimento implantando discos bajo el panículo carnoso, utilizado clínicamente en la reconstitución de la oreja y trasplantando con injertos de piel dermoepidérmica prevascularizada encima. El equipo reguló semanalmente el proceso de cicatrización tras la implantación y documentó fotográficamente el proceso para detallar la maduración macroscópica de la piel.
A continuación, mediante estudios histológicos, los investigadores evaluaron los discos de cartílago en el panículo carnoso de EarSkin y observaron la presencia de capilares humanos en la capa dérmica de EarSkin con fibroblastos englobados, mientras que los discos de cartílago seguían siendo avasculares. A continuación, mediante estudios histológicos e inmunohistológicos, confirmaron la maduración tisular de los discos cartilaginosos. Los resultados pusieron de relieve la importancia del proceso de maduración durante el tiempo de cultivo.
EarSkin y discos cartilaginosos in vivo. (A) Diseño experimental de la combinación de EarSkin y discos cartilaginosos in vivo. Los discos cartilaginosos se imprimieron y maduraron in vitro durante nueve semanas. EarSkin se cultivó durante tres semanas in vitro para obtener un injerto cutáneo dermoepidérmico prevascularizado. Se implantaron discos de cartílago bajo el panículo carnoso, encima del cual se implantó EarSkin. Tras una y cuatro semanas in vivo, se extirparon y analizaron las construcciones. (B) Esquema del procedimiento quirúrgico con el panículo carnoso colocado entre los discos cartilaginosos y EarSkin. (C a I) Imágenes macroscópicas que muestran el procedimiento quirúrgico (C a G) y el control de la herida en la primera semana (H) y en la cuarta semana (I). (C) Inserto de cultivo celular con EarSkin y disco de cartílago al lado, fotografiado directamente antes del trasplante, (D) apertura de la herida mediante incisión, en piel de rata y panículo carnoso; el panículo carnoso se sujeta con pinzas, (E) inserción del disco de cartílago debajo del panículo carnoso, (F) inserción del anillo metálico que protege el EarSkin trasplantado del crecimiento excesivo de la piel de rata, (G) sutura del EarSkin encima del panículo carnoso, y (H) control de la herida en la semana 1 y (I) en la semana 4. (J) Análisis planimétrico de la cobertura EarSkin de los discos cartilaginosos tras una y cuatro semanas in vivo. El valor 100% corresponde al tamaño original del sustituto cutáneo en el momento del trasplante. n = 6 (1 semana), n = 3 (4 semanas). *P < 0,05, **P < 0,01, ***P < 0,001, prueba t no apareada. Crédito: Science Advances, DOI: 10.1126/sciadv.adh1890
Combinación de EarSkin y EarCartilage en un modelo animal
Zielinska y sus colegas utilizaron EarCartilage como topografía tridimensional próxima a la fisiológica para el panículo carnoso y EarSkin. Combinaron las dos estructuras de ingeniería biológica y evaluaron su funcionalidad. Tras el trasplante, continuaron el proceso de cicatrización de la herida y estudiaron la maduración de EarSkin.
Antes de implantar el constructo, el EarCartilage mostraba un comportamiento flexible y elástico con un módulo de compresión. Entre una y cuatro semanas in vivo, el equipo conservó la morfología del EarCartilage junto con su estructura, en la que los constructos auriculares seguían siendo significativamente más blandos. Mediante resultados histológicos e inmunohistoquímicos, confirmaron la deposición de variantes de colágeno y elastina.
Perspectivas
De este modo, Dominika Zielinska y su equipo combinaron con éxito dos injertos de ingeniería tisular creados en el laboratorio en forma de injerto de piel humana de ingeniería tisular (EarSkin) e injerto de cartílago humano bioimpreso (EarCartilage). El planteamiento presentó una estrategia de tratamiento innovadora y prometedora para pacientes nacidos con microtia, ya que puede obviar la extracción de cartílago costal, para así facilitar la intervención a una edad más temprana, así como proporcionar una opción quirúrgica estética personalizada para la microtia basada en células derivadas del propio paciente.
Durante los experimentos in vivo en un modelo animal, el equipo utilizó el panículo carnoso, una capa muscular muy vascularizada, como equivalente al colgajo de fascia temporal humana.
Los científicos observaron un proceso de remodelación de la vasculatura humana trasplantada in vivo con redes capilares de ingeniería humana, tan sólo cuatro semanas después del trasplante. Las estructuras EarSkin-EarCartilage se mantuvieron estables in vivo y conservaron su forma durante todo el proceso de implantación, lo que demuestra el éxito de la combinación de dos estructuras de cartílago y piel tridimensionales, creadas por ingeniería tisular, como estrategia de tratamiento personalizado de la microtia infantil.
Para más información: Dominika Zielinska et al, Combining bioengineered human skin with bioprinted cartilage for ear reconstruction, Science Advances (2023). DOI: 10.1126/sciadv.adh1890
Benjamin P. Cohen et al, Ingeniería tisular del pabellón auricular humano mediante el coimplante de condrocitos auriculares y células madre mesenquimales, PLOS ONE (2018). DOI: 10.1371/journal.pone.0202356
Información de la revista: Science Advances, PLoS ONE



Comentarios
Publicar un comentario